Het lussen van DNA ontrafelen met DelftBlue en experimenten
Eiwitten (proteïnen) vervullen tal van essentiële functies in onze cellen, waaronder het samenpakken van lange DNA-strengen tot een minuscule structuur in de celkern. Roman Barth, experimenteel biophysicus, wilde tot op moleculair niveau begrijpen hoe dit lussen van DNA werkt. Dankzij de DelftBlue supercomputer kon hij meerdere jaren aan experimenten tot één jaar terugbrengen.
Als je de volgorde van aminozuren weet waaruit een eiwit bestaat, dan is niet ook meteen de driedimensionale vorm ervan duidelijk. En weet je die structuur, dan zegt dat heel weinig over de functie van het eiwit en over de interacties die het met andere moleculen aangaat bij het uitvoeren van die functie. Dit is de uitdaging die Roman Barth aanging tijdens zijn promotieonderzoek in het Cees Dekker Lab van de afdeling Bionanoscience.
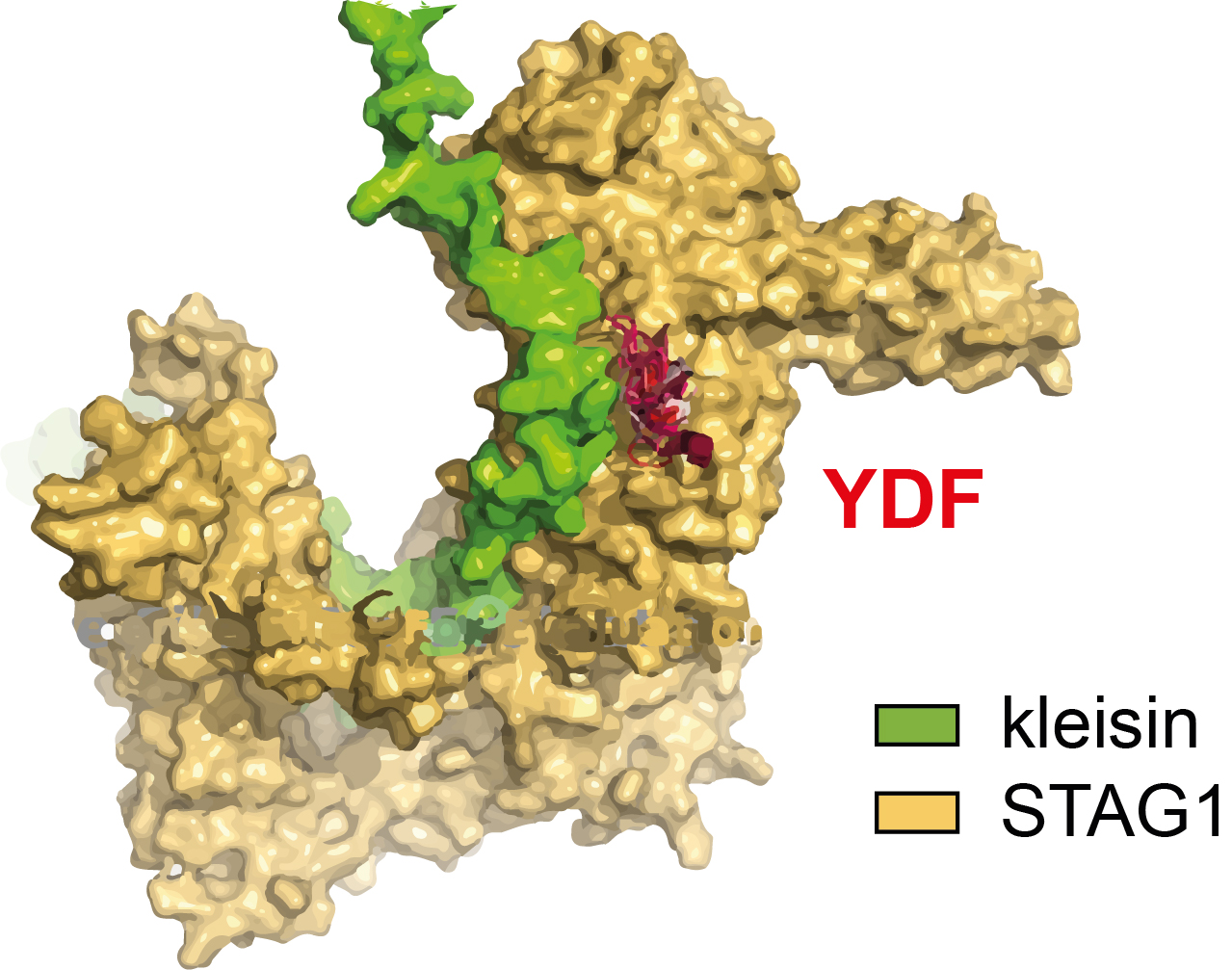
“Ik wilde de interactie ontrafelen tussen twee eiwitten waarvan we weten dat ze betrokken zijn bij het samenpakken van DNA,” zegt hij (DNA loop extrusion, zie video). “Het eerste eiwit, cohesin, zal het DNA steeds verder lussen, tenzij het ergens door gestopt wordt. Het tweede eiwit, CTCF, is juist een soort stopbord voor cohesin. Dat is erg belangrijk voor de cel omdat DNA bijvoorbeeld toegankelijk moet zijn om te worden gelezen of onderhouden.”
De interacties tussen twee eiwitten kunnen we nog niet vanuit fundamentele natuurkundige en scheikundige principes voorspellen.
AlphaFold
Hoe de twee eiwitten met elkaar de interactie aangaan hangt af van hun driedimensionale vorm, van de delen daarvan die dicht bij elkaar komen, en van de krachten die vervolgens tussen groepen atomen optreden. “Dit kunnen we allemaal nog niet vanuit fundamentele natuurkundige en scheikundige principes afleiden,” zegt Roman. “CTCF is dan nog een vrij eenvoudig eiwit, maar cohesin bestaat uit vijf uitwisselbare componenten waardoor er heel veel configuraties en interacties mogelijk zijn.”
Toen hij in 2023 met dit project startte leek een jarenlange experimentele aanpak de enige haalbare optie. Maar toen verscheen AlphaFold ten tonele. “AlphaFold is een algoritme, op basis van kunstmatige intelligentie, dat de structuur van eiwitten voorspelt aan de hand van de volgorde van hun aminozuren,” zegt Roman. “Dat was een game changer voor ons. Nu konden we voorspellingen doen over hoe onze eiwitten eruitzien, en wat er gebeurt als ze bij elkaar komen. In plaats van jarenlang experimenten uitvoeren met allerlei mogelijke configuraties van CTCF en cohesin, voorspelde de computer de meest waarschijnlijke interacties en testten we alleen die in het lab.”
Met project storage kunnen meerdere gebruikers, van verschillende afdelingen, op DelftBlue dezelfde veeleisende installatie delen.
Krachtige computer
De uitdaging bij AlphaFold was echter wel dat het een krachtige computer vergt. Een met veel opslagruimte voor de 5 Tb database die het programma raadpleegt en met heel veel rekenkracht om het algoritme te kunnen draaien. “Op een laptop of desktop lukt dat eigenlijk niet en we hadden niet de expertise om een eigen rekencluster te bouwen. Dat DelftBlue recent online was gekomen was dus een tweede meevaller voor ons.”
Bovendien bleek een andere onderzoeker – Marcel van der Broek van de afdeling Biotechnology – Alphafold al op DelftBlue te hebben geïnstalleerd. Precies een scenario waarvoor de DelftBlue beheerders zogenoemde Project Storage hadden opgezet. “Met project storage kunnen meerdere gebruikers, van verschillende afdelingen, dezelfde veeleisende installatie delen, in plaats van dat iedere onderzoeker het opnieuw moet installeren. Marcel en ik waren de eersten die hiervan voor AlphaFold gebruik maakten.”
Beginner
Roman had nog nooit op een rekencluster gewerkt voordat hij met DelftBlue in aanraking kwam, maar hij vond al gauw zijn weg. “DelftBlue heeft een gebruiksvriendelijke interface, geweldige documentatie en een heel bekwaam en behulpzaam ondersteuningsteam,” zegt hij. “Daarmee kun je jezelf prima redden.” De maximale looptijd van vijf dagen voor rekentaken omzeilde hij door het CTCF-eiwit in kleinere fragmenten op te breken. “Het zou fijn zijn als DelftBlue nog grotere GPUs krijgt, of dat je meerdere GPUs tegelijk voor één rekentaak kunt gebruiken – vooral wanneer het op kunstmatige intelligentie aankomt.”
Hij benadrukt dat de DelftBlue beheerders zeer bereidwillig zijn om nieuwe dingen uit te proberen. “Hun houding was er echt een van ‘dat lijkt me best nuttig, hier heb je de middelen waar je om vroeg,’” zegt Roman. En als hij Delftblue op de proef stelde, door bijvoorbeeld enkele honderden rekentaken tegelijk aan te bieden, dan waren de beheerders net zo nieuwsgierig naar hoe het cluster daarmee om zou gaan. “De planningsoftware die de taken prioriteert had daar totaal geen moeite mee.”
Als we alles puur experimenteel hadden moeten uitzoeken dan hadden we daar minstens drie keer zo lang voor nodig gehad.
Twee waarschijnlijke interacties
Met AlphaFold en DelftBlue kon Roman vooraf honderden verschillende combinaties evalueren, wat twee waarschijnlijke interacties opleverde. Deze valideerde hij vervolgens in het laboratorium, met experimenten waarbij hij keek naar hoe deze twee CTCF-fragmenten het lussen van DNA beïnvloedden. Zulke fragmenten kun je tegenwoordig vrij eenvoudig uit cellen isoleren, maar zelfs dan kostte het zo’n zes maanden om de experimenten te voltooien. “We hebben het project binnen een jaar afgerond. Als we alles puur experimenteel hadden moeten uitzoeken dan hadden we daar minstens drie keer zo lang voor nodig gehad.”
Met zijn pas verkregen Schmidt Science Fellowship begint Roman nu aan een postdocpositie aan de University of Washington in Seattle. Daar zal hij zich nog veel verder verdiepen in AlphaFold en het voorspellen van eiwitstructuren. “Mijn tijd aan de TU Delft en met DelftBlue is een hele goede voorbereiding geweest voor deze volgende stap in mijn carrière. Ik hoop dat de beheerders van de supercomputer aldaar net zo open-minded en behulpzaam zijn.”